· モルとは個数のことでした。 (1mol = 60×10 23 個) 公式です。 モル濃度 mоl L 溶質の物質量 mоl 溶液の体積 L モ ル 濃 度 m о l / L = 溶 質 の 物 質 量 m о l 溶 液 の 体 積 L 溶質の物質量 mоl モル濃度 mоl L 溶液の体積 L 溶 質 の 物 質 量 m о l = モ ル 濃 度 m о l / L × 溶 液 の 体 積 L 例題1 NaOH = 40のとき、NaOHgを水に溶かして全体でLとしたときの · 化学「モル(mol)」ってどう覚えたらいいんですか? いろんな単位や式の使い方があって使いこなせません。速さ、距離、時間の関係をバス停のような形で表した覚え方ってありますよね?あんな感じの覚え方ありませんか? 高校の最物質1molあたりの質量は、原子量・分子量・式量に単位〔g〕をつけたもの まずは、 (1)です。 問題文より、アルミニウム Al の原子量は27です。 ということは、アルミニウム1molあたりの質量は、 27g です。 このことから、比例式を立ててみましょう。 1mol27g= 3mol x g x=81 よって、答えは、 81g です。 次は、 (2)です。

4 6 溶液の濃度 おのれー Note
化学 の モル 公式
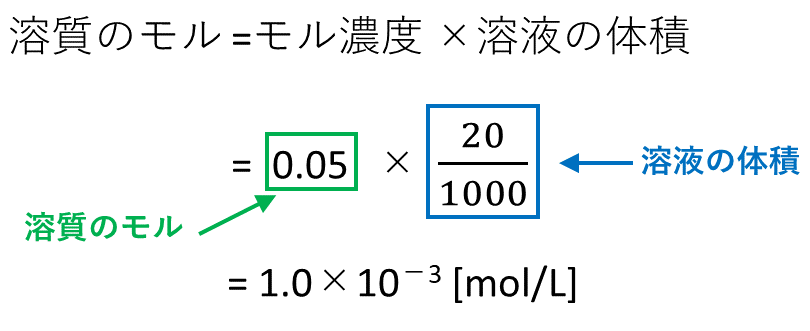
化学 の モル 公式-図241では,純粋A場合を考える.純粋A1モルの自由エネルギーをΔG m,A とする.フラスコにあるAの量にかかわらず,仮にAを1モルだけ集めたとき,Aの化学ポテンシャルは,ΔG m,A であり,この値をμ 0 A とおく.そこに,物質 B を加えたとき,Aのモル分率を,x · モル濃度は基本的には上で紹介した公式に溶質のmol、溶液のLを代入すれば求めることができる。 問題 molの水酸化ナトリウム(NaOH)を水に溶かして全体で40Lにしたときのモル濃度mol/Lを求めよ。 公式に当てはめると次のようになる。 モル濃度 溶質 溶液 モ ル 濃 度 ( m o l / L) = 溶 質 ( m o l) 溶 液 ( L) = ( m o l) 40 ( L) ≒ 050 ( m o l / L) 毎回このように出題して



物質量の計算の公式を 木の下ハゲじじいの きはじ 風にやると Yahoo 知恵袋
モル吸光係数とは特定物質の吸光度Abs を、測定化学種1 モル濃度(1 mol/L)、1 cmの吸収セルに換算した値で、波長、温度などによって決まる定数。 ε をモル吸光係数または分子吸光係数と呼びます。化学基礎が終わった次の化学ではこのルールは通用しないので注意が必要ですが、ひとまずは1mol=224Lと覚えておきましょう。 くどいですが、 気体だけの法則 ということを忘れないでください。 溶液の濃度はmol(モル) ÷ L(リットル)#モル濃度 求め方 公式 #溶液の調製 #硫酸銅 高校化学 エンジョイケミストリーモル濃度の定義、計算方法、溶液の調製について調製手順と注意点
モル数n 分子を重さではなくて分子の数で考えると便利な 場合がある(化学反応など)。 2H2 O2 →2H2O 質量だと 2g 16g → 18g 数だと 2個 1個→ 2個 モル数n しかし分子は小さいため数が大きく高校講座HOME >> 化学基礎 化学基礎 Eテレ 毎週 水曜日 午後2:00~2: ※この番組は、21年度の新作です。 出演者紹介 · 2:モル濃度の計算方法・求め方(公式)と単位 モル濃度とは、先ほど解説した通り、「溶液1Lあたりに、どれだけの溶質molが含まれているか?を示したもの」です。 したがって、モル濃度の公式は、 溶質の物質量mol / 溶液の体積L となります。
· 凝固点降下の公式 ΔT f = K f ・m ΔT f :凝固点降下度 K f :モル凝固点降下(定数:溶媒に固有)(K・kg/mol) m:質量モル濃度(mol/kg) · 化学基礎 モル質量など公式まとめ 化学基礎の教科書問題なのですが答えが載っていません。分かるところのみでも構いませんので答えがあっているか、また5⃣の答えを教えて下さい🙇♂️ · molって何?molとはなにか、受験生なら知ってて当然です。逆に知らない人は、危ない!よくここで復習しておきましょう。 molとは、物質量を表す単位のことですが、まず物質量とはなにか。 物質量とは、簡単に言うと 「物質そのものがどれだけそこに存在しているかを表す数値」 です。




これでできる モル Mol 計算 化学基礎 最大の難所を突破しよう 化学 アイドル好きのホームページ



第93章 理想気体の状態方程式
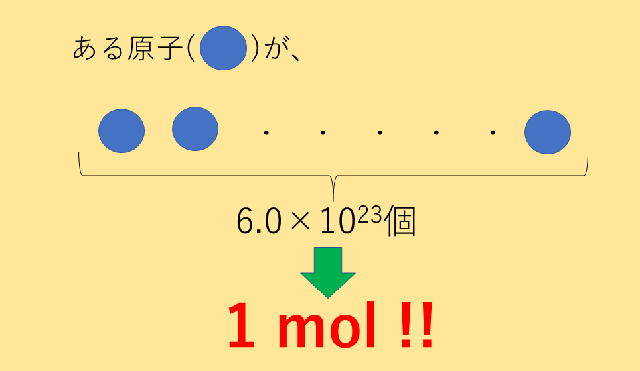
モル(mol)ってなに? 1molとは602×10 23 個のこと。 いちいち602×10 23 個と書くのもわずらわしいため、化学ではこれを1molという。 モル質量とは、その物質が602×10 23 個集まったときの質量。 モル体積とは、その物質が602×10 23 個集まったときの体積。 窒素や水素などの気体の場合、物質1 molの質量をモル質量と呼ぶ.従って,水分子のモル質量は 180 g mol 1 ,炭素原子のモル質量は1 g mol 1 ,ナトリウムイオンのモル質 量は230 g mol 1 となる.物質の質量をはかれば,比例計算によって物質量を質量 (g)=物質量 (モル)×原子量 (分子量・式量) 物質量 (モル)=質量 (g)÷原子量 (分子量・式量) 原子量 (分子量・式量)=質量 (g)÷物質量 (モル) 粒子の個数=物質量 (モル)×アボガドロ数 気体の体積=物質量 (モル)×224 この図をしっかりと描けるようになれば、この単元における計算問題は怖くはありません。 次:実際に練習問題を解いてみましょう 1ページへ戻る




高校化学基礎 モル質量の計算 練習編 映像授業のtry It トライイット




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月
化学のグルメ pH計算定義から公式、求め方、希釈や混合 次亜塩素酸ナトリウムの希釈の計算式の覚え方は簡単です。 寒い季節がやってくると心配なのが感染症、インフルエンザやノロウイルスなど、感染症予防が大切になってきます。 中和 モル高一 化学基礎 物質量(mol)の 公式の覚え方教えてください mol濃度の公式も教えてください お願いします




4 6 溶液の濃度 おのれー Note




高校1年 化学 モルのところです 写真の問題のがわかりません N2 高校 教えて Goo




高2 化学 公式まとめ 高校生 化学のノート Clear



物理や化学の計算が簡単にできる方法




高校理論化学 酸化還元反応の量的関係 受験の月




物質量molの超解説 理系ラボ




カルピスの乳酸のモル濃度を書かないといけないんですが この式に自分 化学 教えて Goo




理論化学の計算なんて簡単 分野問わず2大方針で撃破 化学受験テクニック塾




4 6 溶液の濃度 おのれー Note




中和反応と塩 モル濃度を求める中和滴定の実験の 水溶液の希釈 がわかりません 化学基礎 定期テスト対策サイト




化学基礎 化学反応と量的関係 1of4 Youtube




物質量molの超解説 理系ラボ




18問 Mol計算 危険物取扱者 乙種4類 乙4 の公式過去問 解説




5分でわかる 分圧 全圧との違いは 混ざっているのに圧力は分けられる 元研究員がわかりやすく解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン




モルって何 化学における数の数え方 図解でわかる危険物取扱者講座




物質量




アボガドロ 定数 アボガドロ定数とは 原子量 分子量 モルとの関係と物質量の求め方 高校生向け受験応援メディア 受験のミカタ



17センター試験 化学 基礎じゃない方 解答解説速報 とある化学教師でググって 楽天ブログ




ファラデーの法則 電気量計算の公式 解き方 演習問題付き 化学のグルメ




高校生 モル計算のノート一覧 Clear



高校1年化学基礎です 5番の問題がさっぱりわかりません モル濃度の公式と質量 Yahoo 知恵袋




モル計算
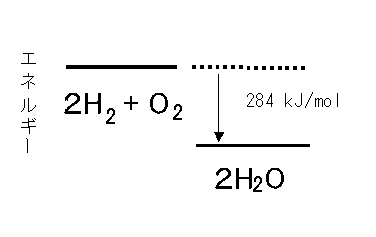



水素の燃焼
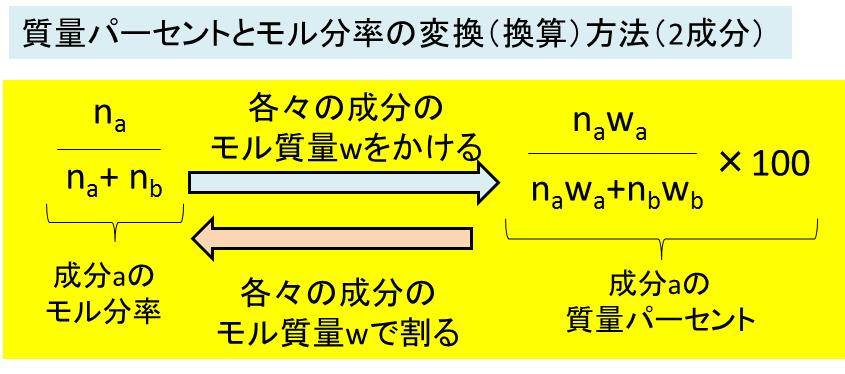



質量パーセントとモル分率の変換 換算 方法 計算




高2 化学 物質量 公式まとめ 高校生 化学のノート Clear



高一化学基礎です 助けてください 先生から教わった公式なのですが当てはめ Yahoo 知恵袋
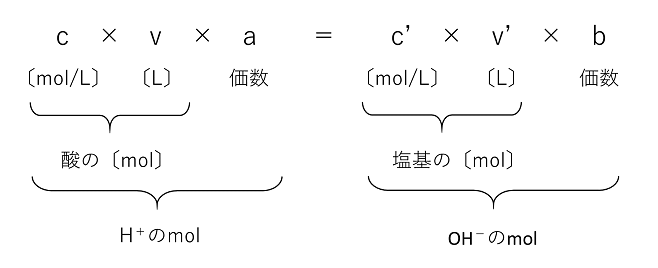



中和反応
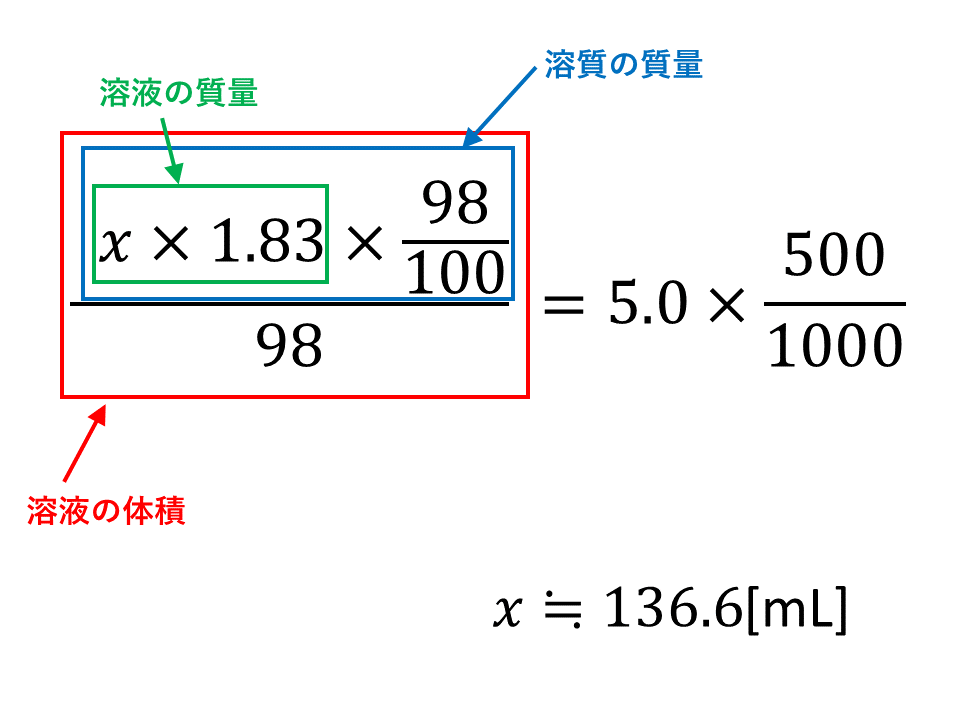



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
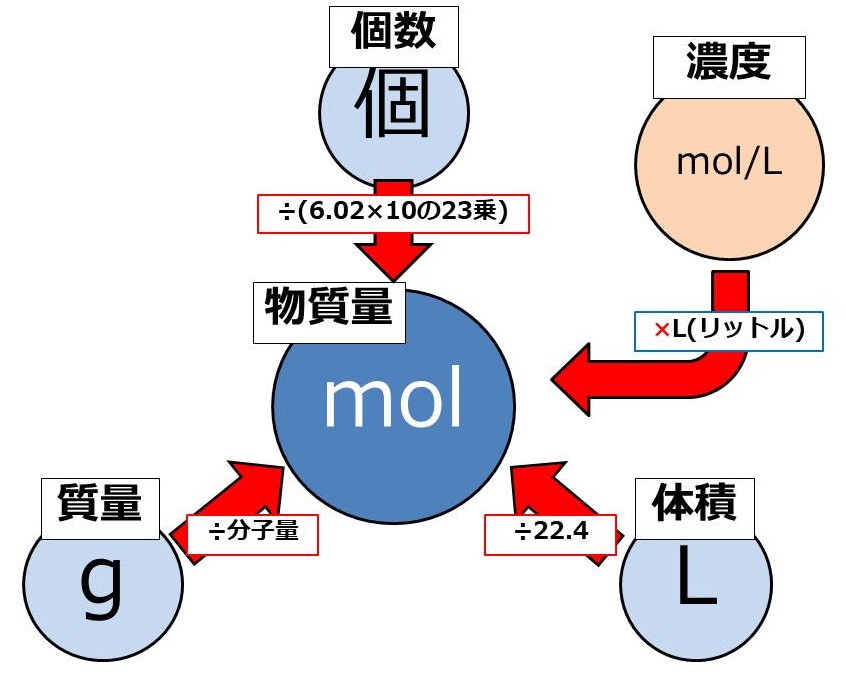



Mol モル の計算と公式 感覚でカンタンに考える化学




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




モル 濃度 の 求め 方 Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




文系脳のキミでもわかる 化学のmol計算対策 高校生3分ニュース 進研ゼミ高校講座




医療工学科の化学講義 7 モルと化学反応式 特に新しいmolについて Life Chemistry
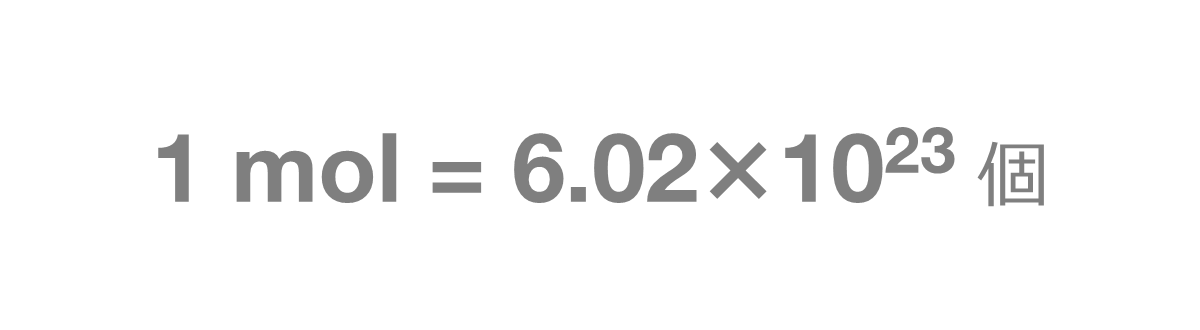



モルって何 化学における数の数え方 図解でわかる危険物取扱者講座




医療検査学科の化学講義 7 モルと化学反応式 特に新しいmolについて Life Chemistry




モル 濃度 計算




分子量とは 単位もわかる 高校化学で必見の計算方法とは 高校生向け受験応援メディア 受験のミカタ




モル Mole Unit Japaneseclass Jp
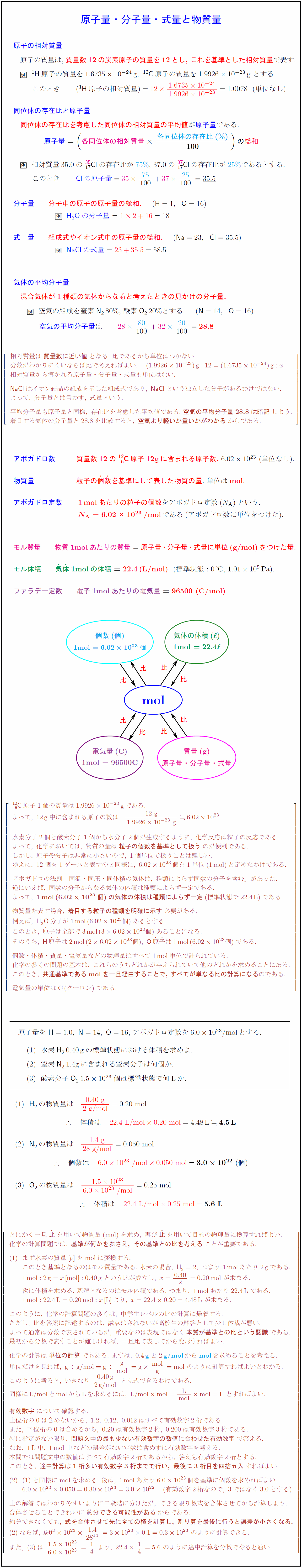



高校理論化学 原子量 分子量 式量と物質量 Mol 化学計算の基本 受験の月
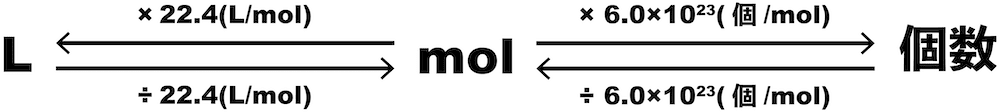



モル計算 単位を駆使 物質量molが絡む問題の解法 原子量 体積 アボガドロ数など 化学のグルメ




モル 計算 公式 Mol モル の計算と公式 感覚でカンタンに考える化学




高校化学基礎 モル体積とは 映像授業のtry It トライイット




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




公式がわかれば 文字式計算の問題も 化学がちょっとだけ好きな社労士
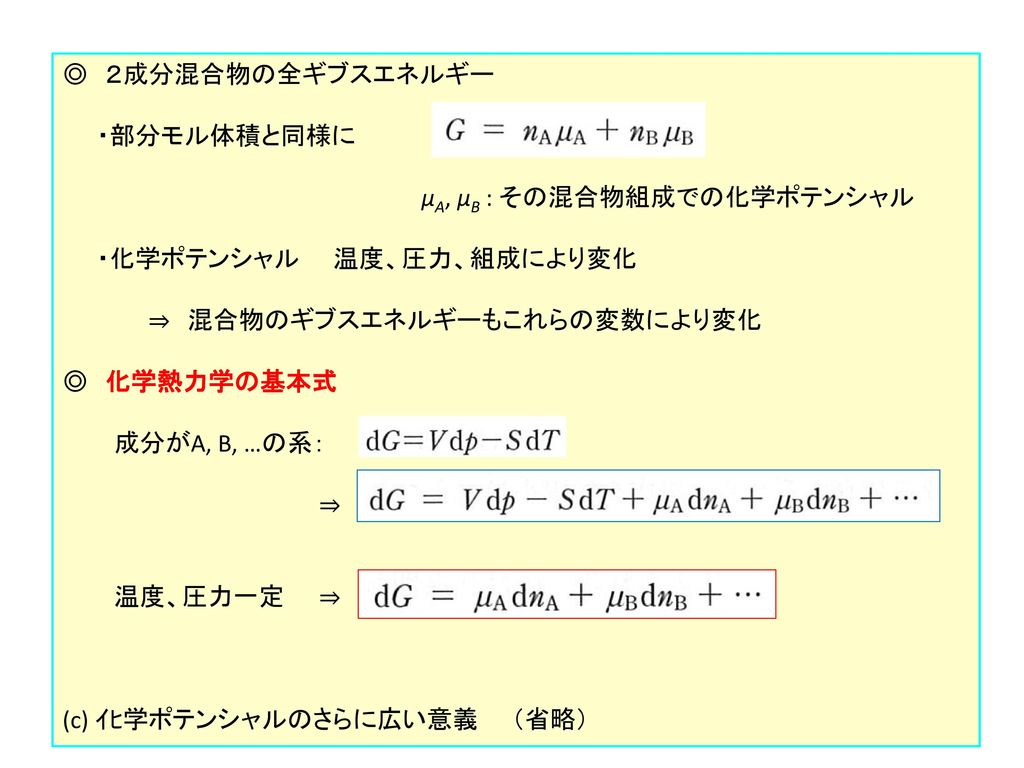



本章 化学ポテンシャルという概念の導入 部分モル量という種類の性質の一つ 混合物の物性を記述するために 化学ポテンシャルがどのように使われるか 基本原理 平衡では ある化学種の化学ポテンシャルはどの相でも同じ 化学 互いに反応できるものも含めて




モル 濃度 計算 モル分率 モル濃度 質量モル濃度の求め方を教えてください




化学基礎 モル 物質量 の計算問題 標準状態の気体の体積など の解き方 計算力に応じて対応していきましょう 比の使い方 単位を使った解法など 井出進学塾 富士宮教材開発 公式ブログ Note




モル計算 単位を駆使 物質量molが絡む問題の解法 原子量 体積 アボガドロ数など 化学のグルメ




Molの計算 スマート解法 高校生 化学のノート Clear



受験化学 14 凝固点降下 みかみの参考書ブログ



放課後化学講義室 公式は問題に書いてある
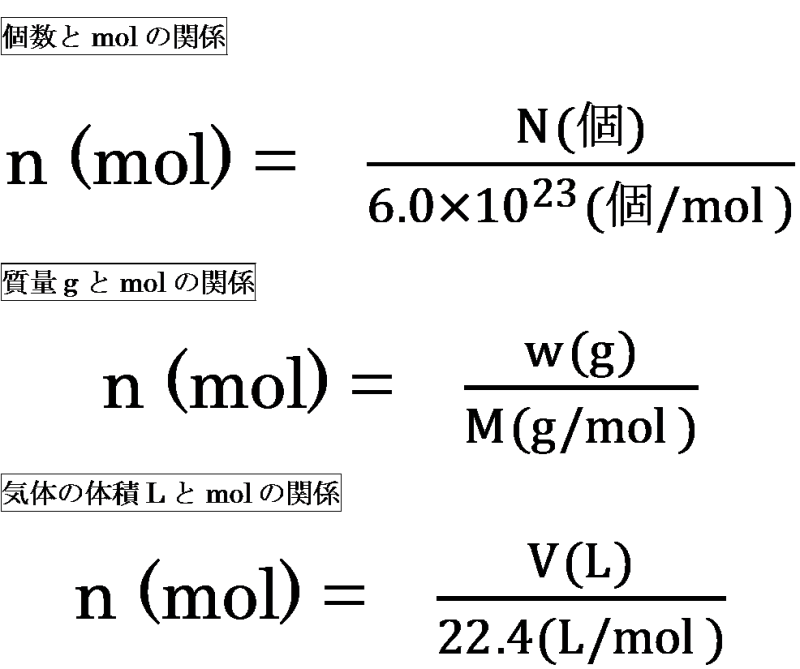



Molと個数 Molと質量g Molと気体の体積lの式は機械的に 化学がちょっとだけ好きな社労士




5 2 化学反応の量的関係 1 おのれー Note




高校化学 物質量 伊賀上野 はなまるせんせいの独り言




化学基礎 モル濃度を簡単に計算する方法 Youtube




大学入試難問 化学解答 数学編 微分法 富岡市の総合学習塾 トータルアカデミー
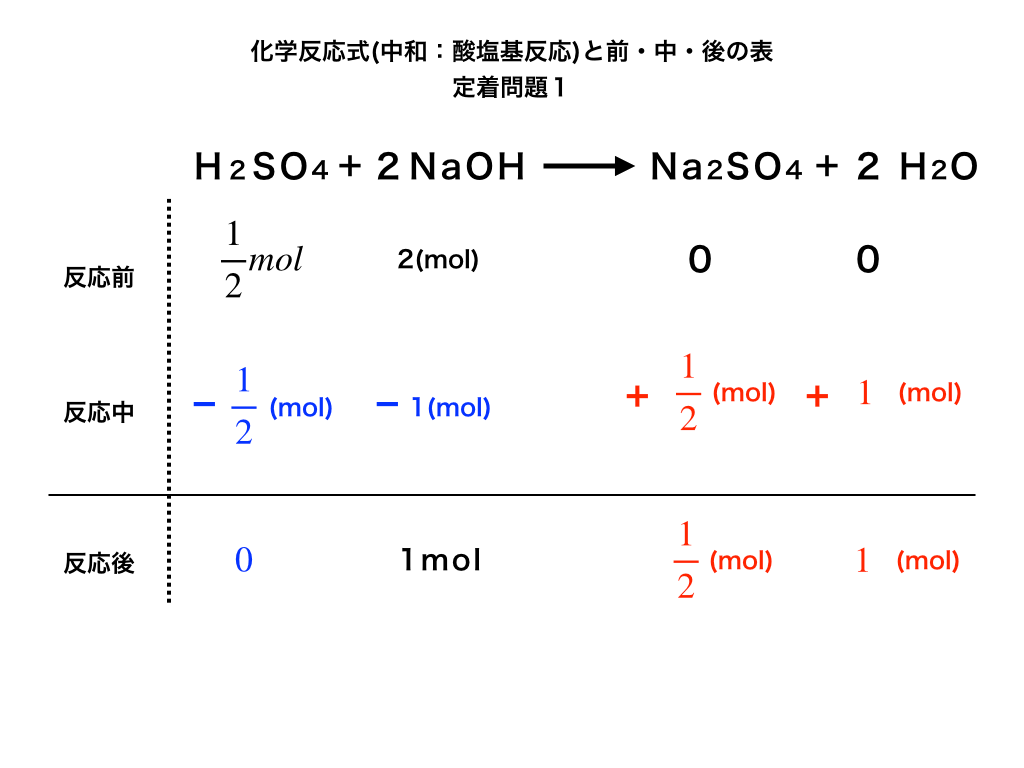



過不足のある化学反応の問題を解くコツと必ず書くべき図 保存版




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




高校化学 質量モル濃度 映像授業のtry It トライイット



アボガドロ数の測定法




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




モル 公式 イメージポケモンコレクション




気体の体積の公式 キーワードは22 4 化学がちょっとだけ好きな社労士




モル 質量 求め 方



文系脳のキミでもわかる 化学のmol計算対策 高校生3分ニュース 進研ゼミ高校講座
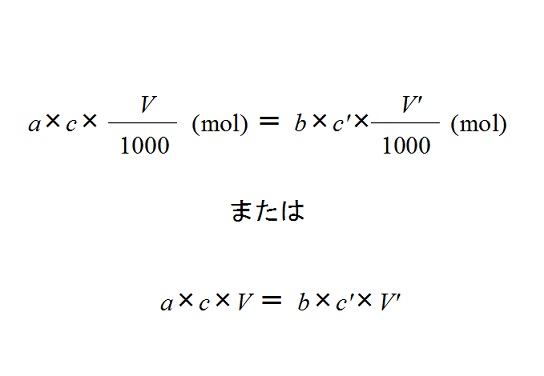



中和反応の量的関係と中和の公式




Molで覚えるべき公式は何ですか 明日定期テストなのですが 全くわかりません Clear



物質量の計算の公式を 木の下ハゲじじいの きはじ 風にやると Yahoo 知恵袋




高校化学基礎 モル質量の計算 練習編 映像授業のtry It トライイット
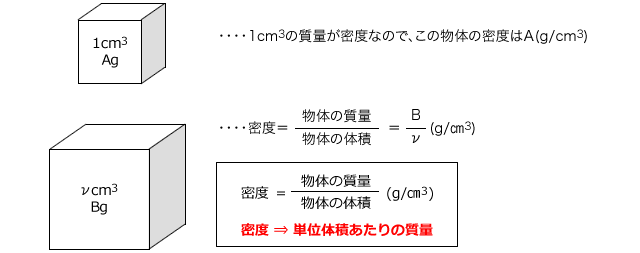



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
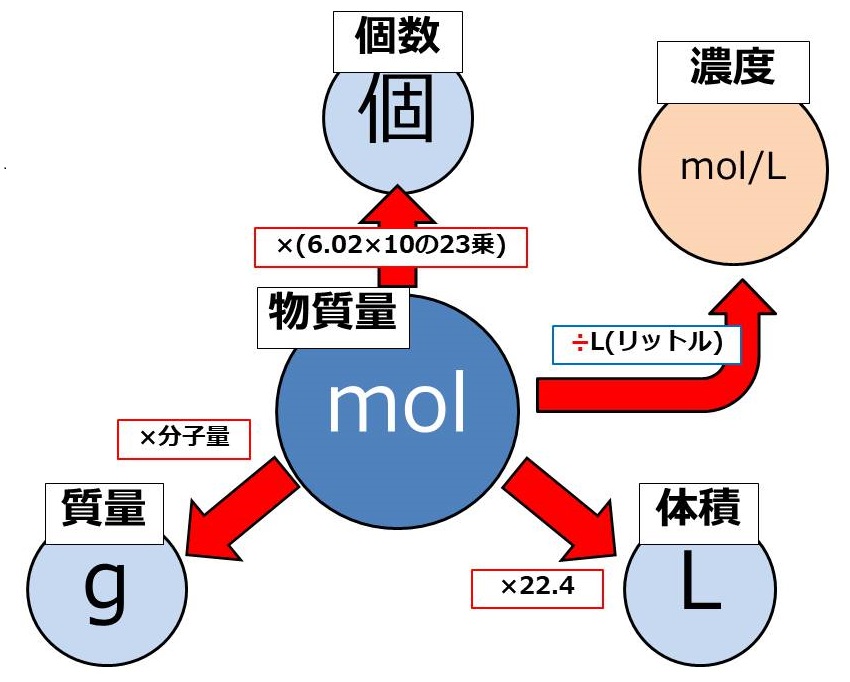



Mol モル の計算と公式 感覚でカンタンに考える化学




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



看護学部の化学講義 8 モルと化学反応式 Life Chemistry




センター試験 化学基礎 の攻略 Molの計算 問題10解説 Youtube
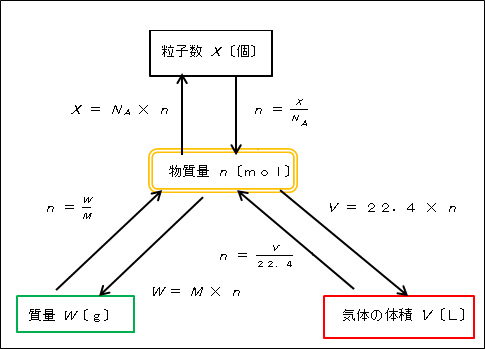



物質量 の指導における イメージ化 化学授業実践記録 アーカイブ一覧 理科 高等学校 知が啓く 教科書の啓林館




質量モル濃度 化学がちょっとだけ好きな社労士




高1 化学基礎 物質量と化学反応式 高校生 化学のノート Clear




高校化学基礎 モル質量とは 映像授業のtry It トライイット




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




高校化学 凝固点降下の原理をわかりやすく徹底解説 なんで電解質の方が凝固点が下がりやすいの 化学の偏差値が10アップするブログ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




密度公式




化学 原子量 分子量 式量とモル質量 オンライン無料塾 ターンナップ




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法



受験化学 5 気体の状態方程式 みかみの参考書ブログ




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ
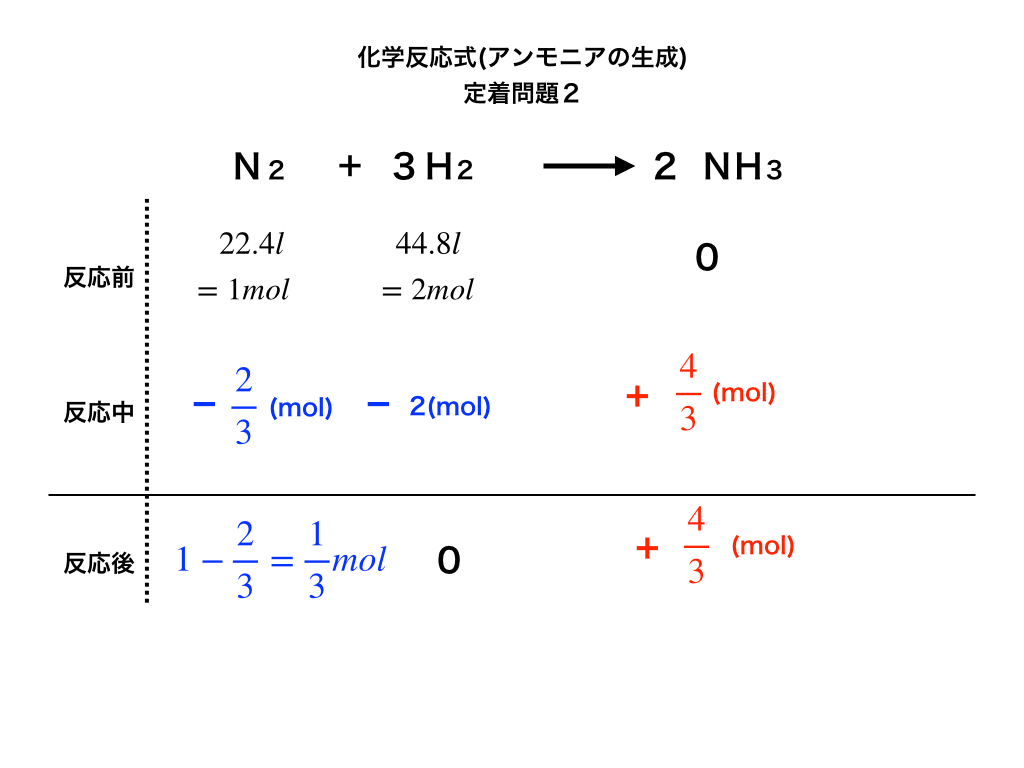



過不足のある化学反応の問題を解くコツと必ず書くべき図 保存版




化学基礎 モル質量など公式まとめ 高校生 化学のノート Clear




化学平衡 3 4 を教えてください Okwave




高校化学基礎 ダースと本数 映像授業のtry It トライイット




沸点上昇 凝固点降下 富岡市の総合学習塾 トータルアカデミー



文系脳のキミでもわかる 化学のmol計算対策 高校生3分ニュース 進研ゼミ高校講座




物質量 Mol とモル質量と原子量の関係


